... Tumor de Celulas Gigantes ...
Frecuencia, edad,sexo y localización
Manifestaciones clínicas
Complicaciones
Se han citado las metástasis pulmonares como causa de la muerte en 16-25% de los casos divulgados (Kay, 1994; Maloney, 1989; Roca, 1984). Es muy importante la detección temprana y el tratamiento de estas metástasis.
La transformación maligna espontánea del tumor de células gigantes no es infrecuente. La transformación maligna se ha definido como la aparición de un sarcoma asociado a un tumor de células gigantes típico benigno en la presentación o como sarcoma que se presentaba en el sitio de un tumor de células gigantes preexistente (Unni, 1996; Anract, 1998 # 80). Las transformaciones malignas han dado lugar a osteosarcoma, fibrosarcoma, o histiocitoma maligno (Benjamin, 1999; Gitelis, 1989; Mori, 2000; Ortiz-Cruz, 1995). Se han informado periodos de 4-40 años para la trasformación maligna de un tumor de células gigantes (Rock, 1984; Gitelis, 1989; Mori, 2000; Hefti, 1992).
Muchos autores han informado de una asociación fuerte entre la radioterapia y la transformación maligna del tumor de células gigantes (Unni, 1996; Campanacci, 1987; Goldenberg, 1970; Dahlin, 1970; Mori, 2000; Hefti, 1992; Roca, 1986). Sin embargo, mucha de esta información fue derivada durante la era de la radiación con orthovoltage. Estudios recientes han examinado el efecto de la radiación con megavoltage y han demostrado que es bien tolerada y no provoca transformación maligna (Bennett, 1993; Chen, 1986; Malone, 1995; Nair, 1999; Schwartz, 1989). Los tumores de células gigantes que han experimentado la transformación maligna se tratan como sarcomas.
Estudios de imagen
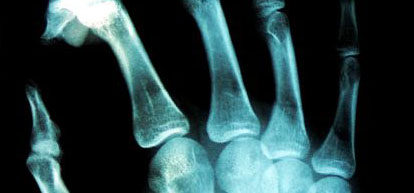
Las radiografías normalmente revelan una lesión bastante destructiva de hueso medular y cortical. La lesión se caracteriza por una zona expandida de radiolucencia que se localiza excéntricamente en el extremo de un hueso largo en un adulto.
Cuando un tumor de células gigantes sobrepasa los límites de la cortical, puede haber una masa de tejidos blandos. La lesión puede extenderse y puede involucrar el hueso subcondral periarticular. Aunque las radiografías del tumor de células gigantes demuestran una zona estrecha de transición (bien definida), El tumor de células gigantes carece generalmente la esclerosis periférica densa vista en fibromas no osificantes. La mineralización de la lesión primaria es rara. Sin embargo, cuando el tumor de células gigantes ocurre en las partes blandas (metástasis o recidiva local), las calcificaciones periféricas son frecuentes.
Aunque la tomografía computadorizada es bastante útil para determinar el adelgazamiento del hueso y para evaluar el margen de hueso delgado asociado que rodea la lesión, no es tan eficaz como la resonancia magnética en la evaluación de la penetración cortical subcondral, la implicación de la articulación, y la fractura patológica. La resonancia magnética es la técnica más útil, morfológicamente, para determinar la magnitud y estadio de un tumor giganto-celular local.
El rastreo
óseo es útil para el detectar tumor de células gigantes multicéntrico,
que es raro. (Menos del 1 % [cuatro de 460] de los tumores de células
gigantes en el estudio de Schajowicz era de este tipo.)
Histopatología
La situación es muy importante en el diagnóstico de tumor gigante-celular benigno. Aunque el tumor de células gigantes se ha descrito históricamente como un tumor epifisario, la evidencia más reciente ha indicado que su origen real puede estar en el lado metafisario de la epífisis.
El color del tejido extirpado de un tumor giganto-celular benigno generalmente va del pardusco-marrón claro a amarillo. Las áreas de hemorragia pueden ser rojo oscuras. Las áreas de necrosis pueden aparecer quiste-like. Histológicamente, un tumor giganto-celular benigno contiene predominantemente células gigantes osteoclastos-like y células del estroma fusiformes. Los núcleos de estos dos tipos celulares son redondos u ovalados y de tamaño uniforme, con cromatina granular blanda y el nucleolos prominentes. Las células gigantes nunca muestran figuras mitóticas; sin embargo, las células del estroma pueden mostrar cinco a diez mitosis por diez campos de gran ampliación. No es posible predecir la conducta biológica de un tumor particular en base a su apariencia histológica.
Los tumores de células gigantes exhiben una variedad ancha de actividad biológica. Algunas lesiones actúan de forma bastante benigna, permaneciendo local y no invasiva, y no haciendo metástasis, mientras otros son localmente muy destructivos o metastatizando a los pulmones. Los estudios más sofisticados, como el análisis citométrico de flujo de ADN, no han sido útiles en la predicción de si un tumor puede llegar a metastatizar.
En un esfuerzo para predecir bien las actividades biológicas de los tumores, Campanacci et al. desarrolló un sistema de clasificación, modificado más tarde, basado en una combinación de la clínica, la radiografía, y los resultados patológicos:
|
|
Un tumor estadio-I de células gigantes se define como el que causa síntomas, aparece radiográficamente latente, con márgenes bien definidos y cortical intacta, y tiene un modelo histológica benigno. |
|
|
Un tumor estadio-II de células gigantes puede causar síntomas, puede tener una apariencia radiográfica activa con márgenes relativamente bien conservados, pero no hay margen radio opaco y la cortical está adelgazada y moderadamente expandida. no hay evidencia de metástasis, y puede tener un modelo histológico benigno. |
|
|
Un tumor estadio-III
|
Diagnóstico diferencial
Radiológico
Tumor pardo del hiperparatiroidismo, Puede recordar al TGC, pero suele estar acompañado de otras lesiones esqueléticas del hiperparatiroidismo, tales como osteopenia, resorción cortical o subperióstica, resorción en las falanges distales, o pérdida de la lámina dura de los dientes. |
|
Fibroma no osificante. |
|
Ganglión intraóseo. Esta lesión se acompaña de un borde escleroso. |
|
Quiste óseo aneurismático. Raramente afecta a la epífisis y los pacientes son más jóvenes. Cuando se han cerrado los platillos de crecimiento, el quiste óseo aneurismático puede invadir la parte distal del hueso. En estos caso se puede necesitar de la ayuda de la TAC y la RM. |
|
Mieloma y metástasis líticas situadas en la parte subarticular del hueso. La edad de los pacientes puede ayudar al diagnóstico diferencial. |
|
Condroblastoma. |
|
Condrosarcoma. Si se extiende a la epífisis y no posee calcificaciones puede confundirse con el TGC |
|
Osteoblastoma. |
|
Fibrosarcoma, histiocitoma fibroso maligno, en los casos en que se presentan como lesiones líticas puras. |
|
Osteosarcoma fibroblástico. |
Patológico
Generalmente las lesiones grado I no tienen problemas de diagnóstico diferencial.
En el caso de lesiones grado II o III se deben considerar las siguientes lesiones, por que poseen células gigantes:
Condroblastoma. Puede haber células gigantes. En esta lesión hay islas de cartílago que no se ven en el TGC. |
|
Histiocitoma fibroso benigno. El histiocitoma fibroso benigno puede contener células gigantes, y el TGC puede contener áreas de tejido fibroso estoriforme mezclado con células gigantes similar al histiocitoma fibroso benigno, pero este último capas anchas de células poligonales mononucleares. |
|
Condrosarcoma de células claras. Esta lesión posee grupos de células claras grandes que no posee el TGC. |
|
Fibroma no osificante y defecto fibroso cortical. En el caso de que la lesión que contiene células gigantes se localiza en la metáfisis y el platillo de crecimiento permanece abierto. El carácter histiocítico de estas lesiones lo distingue fácilmente del TGC. |
|
Quiste óseo aneurismático. Las células gigantes son más pequeñas, y sus espacios, que están bordeados por células delgadas indiferenciadas, contienen sangre. |
|
Granuloma reparador de células gigantes. Este tumor pose células gigantes y tiene un componente sólido que recuerda la variante fusocelular del TGC. Puede ayudar al diagnóstico el hecho de que el tamaño de los grupos de células gigantes es más pequeño. |
|
Fibroma condromixoide. Se diferencia por la presencia de grandes áreas de características mixoides. |
|
Tumor pardo del hiperparatiroidismo. Las células gigantes son más pequeñas y poseen una distribución en grupos de características benignas. |
|
Osteosarcoma rico en células gigantes. La inspección cuidadosa del espécimen completo es obligatoria para dejar fuera todas las posibilidades de osteosarcoma. |
|
Histiocitoma fibroso maligno. Puede incluirse en el diagnóstico diferencial cuando está presente la configuración irregular de las células gigantes, generalmente más pequeñas, y la hipercromasia nuclear. |
|
Osteosarcoma telangiectásico. En estos tres últimos tumores puede ayudar al diagnóstico diferencial su localización metafisaria. |
|
Carcinoma metastásico si contiene células gigantes, tales como el tiroides, mama y páncreas. La inmunohistoquímica determina la naturaleza epitelial de estos tumores y la producción de tiroglobulina en el caso de carcinoma de tiroides. |
Como se ha visto hay un gran numero de lesiones tumorales y pseudotumorales que poseen células gigantes. Todas deben tenerse en consideración para hacer el diagnóstico diferencial. (Tabla I)
Tabla I: Lesiones con diferentes formas de células gigantes (CG) |
|
| Tumor o pseudotumor | Tipo de células gigantes |
| Tumor de células gigantes del hueso | Pseudo-osteoclastos y CG muy grandes |
| Osteoma osteoide | CG osteoclásticas |
| Osteoblastoma | CG osteoclásticas |
| Quiste óseo aneurismático | CG osteoclásticas y resortivas |
| Granuloma reparador de células gigantes | CG osteoclásticas y resortivas |
| Quiste óseo simple | CG Osteoclastos y resortivas |
| Condroblastoma | CG "Condroclastos" |
| Fibroma condromixoide | CG "Condroclastos" |
| Condrosarcoma de células claras | CG osteoclásticas |
| Osteosarcoma rico en células gigantes | Tumor y CG osteoclásticas |
| Osteosarcoma telangiectásico | Tumor CG |
| Fibroma no osificante (Def. F. Cortical) | CG Resortivas |
| Histiocitoma fibroso maligno | Tumor CG |
| Tumor pardo del hiperparatiroidismo | CG osteoclásticas |
| Granuloma de células de Langerhans | CG Histiocíticas |
| Enfermedad de Paget | CG osteoclásticas |
| Extraído de Diferential diagnosis of tumors and tumors-like lesions of bones and joints. A. Greenspan and W. Remagen. Editorial Lippicott-Raven. 1998 | |
Tratamiento
El tratamiento del tumor de células gigantes es polémico, y la literatura es confusa.
Hay varias opciones de tratamiento descritas en la literatura actual, incluyendo el siguiente:
curetaje,
curetaje e injerto de hueso,
curetaje e inserción del polimetilmetacrilato (PMMA),
crioterapia después del curetaje de la cavidad,
curetaje y un coadyuvante (fenol, alcohol de cloruro de cinc, y agua oxigenada) y fresado a alta velocidad previo a la inserción de PMMA o injerto óseo,
resección primaria,
radioterapia, y
embolización de los vasos que lo alimentan.
Tradicionalmente, el tumor de células gigantes se ha tratado con curetaje o resección intralesional, que han producido una tasa muy elevada de recidivas con un rango de 35 % - 42 % según las series. Estas cifras hacen pensar en la insuficiencia del procedimiento local, por lo que últimamente se está cambiado a un abordaje más extenso que incluye la resección en bloque, consiguiendo reducir la proporción de repetición local a aproximadamente 10%. La resección en bloque es un procedimiento mayor que normalmente implica el uso de autoinjerto masivo. Mientras la proporción de repetición asociada con esta técnica es bastante baja, las complicaciones como la infección, resorción, colapso, y fractura producen una proporción acumulativamente alta de complicaciones (trece [24 %] de cincuenta y cinco en un estudio y trece [65 %] de veinte en otro ). Esto quiere decir que hay sopesar el riesgo repetición con el curetaje contra el riesgo de complicaciones y un resultado funcional pobre asociado con la resección en bloque. El problema con el curetaje simple es que un tumor de células gigantes forma cavidades contiguas de tumor en el hueso medular y cortical; esto crea un margen irregular y mal definido. El curetaje simple normalmente deja evidencia microscópica residual de enfermedad. Varios autores han informado de la utilización de adyuvantes locales ( fenol, nitrógeno líquido, y láseres de dióxido de carbono) para destruir estos focos microscópicos residuales. Aunque tiene algún sentido para intentar extender el margen localmente con estas varias modalidades, el efecto real de fenol y láseres del dióxido de carbono es incierto. La cauterización con el nitrógeno líquido extiende el margen por la necrosis circunferencial; sin embargo, las complicaciones de quemaduras de la piel y retardo de consolidación de fracturas patológicas son bastante frecuentes con esta técnica.
Aunque los procedimientos intralesionales siguen siendo el tratamiento de elección para la mayoría de tumores de células gigantes, la resección amplia en bloque ofrece la tasa más baja de repetición y se recomienda para las lesiones en ciertas localizaciones. En el peroné proximal, se puede practicar la resección amplia sin reconstrucción. De la misma manera, tumores de células gigantes en el radio distal se pueden resecar en bloque y reconstruir con autoinjertos o aloinjertos. Sin embargo, en los huesos largos, la resección hace necesario la reconstrucción prostética o con aloinjertost (Clohisy, 1994; Kocher, 1998; Mankin, 1982; Mankin, 1976). En lesiones del grado III, ésta puede ser la mejor opción quirúrgica, pero la resección y la reconstrucción se asocia a morbosidad quirúrgica y funcional considerable.
La meta básica en el tratamiento local de tumor de células gigantes es quitar el tejido adecuado sin desestabilizar el área o crear la necesidad de una reconstrucción mayor. Durante la última década, una técnica que combina la escisión local con el uso de cemento de polimetilmetacrilato, o deinjertos oseos se ha convertido en una manera popular de lograr esta meta.
La técnica del curetaje para la extirpación de un tumor de células gigantes comprende la decorticación amplia, o "windowing", de todo el lecho del hueso en el área del tumor. Esto permite la visualización directa de toda la cavidad del tumor. Varios autores han agregado la técnica del fresado de alta velocidad de la cavidad después del curetaje simple intralesional. Una ventana cortical grande es necesaria exponer el tumor y la cavidad enteros del tumor, permitir curetaje cuidadoso y el remover las rebabas de la cavidad. Se ha demostrado que el fresado a alta velocidad reduce la tasa de recidivas a 12-25% (Leeson, 1993; Blackley, 1999). El fresado de alta velocidad agregan no sólo un componente termal a la extirpación del tumor sino también permiten una extirpación más cuidadosa del tumor. Al fresado de alta velocidad de la cavidad se puede asociar con un producto químico o un coadyuvante y un relleno con polimetilmetacrilato o injerto óseo.
Cuando se ha completado la resección, no debe ser visible ningún recoveco, solo el hueso cortical y medular normal. Es importante un lavado minucioso. La cavidad se llenará de cemento óseo de metilmetacrilato para lograr la estabilidad inmediata. Inicialmente, se pensaba que el calor de polimerización del metilmetacrilato extendía los márgenes de la resección local. Sin embargo, éste sigue siendo controvertido. De hecho, el calor que se genera puede causar necrosis del hueso subcondral y del cartílago articular inmediatamente adyacente; por consiguiente, las superficies articular adyacentes deben irrigarse con una solución salina refrescada mientras el cemento está endureciendo para prevenir necrosis por calor del cartílago articular. Después de que el cemento ha endurecido, la ventana cortical se injerta o cubre con matriz ósea desmineralizada para estimular la restauración de límites corticales fuertes. A menos que crea un problema después, el cemento no se retira.
La técnica de cementado con polimetilmetacrilato, comparado con el injerto de hueso, ofrece las ventajas de la carencia de la morbosidad del sitio donante, una cantidad ilimitada, estabilidad estructural inmediata, bajo costo, y facilidad de empleo. Además, el bario contenido en el metilmetacrilato da lugar a una sustancia radio opaca que contrasta agudamente con el hueso circundante. Las recidivas locales son más fácilmente detectables que en los casos en los cuales se utiliza injerto de hueso.
Las desventajas de usar el cemento incluyen dificultad en quitarlo cuando es necesaria la revisión y la posibilidad de que el cemento subcondral puede predisponer a la articulación a una artrosis degenerativa temprana, aunque esto no esta probado.
Las terapias adyuvantes a la resección intralesional incluyen el nitrógeno líquido, el fenol, H2O2, o la coagulación con rayos de argon. todos tiene ventajas y desventajas. Sin embargo, todos ofrecen un método para la extirpación de la enfermedad microscópica. Muchos autores sugieren que el fenol es el medio eficaz de disminuir el índice de recurrencia local de los tumores de células gigantes(Gitelis, 1993; O'Donnell, 1994; Quint, 1998; Capanna, 1985; Durr, 1999; Roca, 1990. Después de que se realice el curetaje y todas las perforaciones en el hueso se sellan, el fenol se vierte en la cavidad. Esto da lugar a una muerte celular en una profundidad de aproximadamente 1-2 milímetros (quint, 1998). La concentración de fenol debe ser al 5%.
Las tasas de recurrencia con curetaje y fenol y relleno con polimetilmetacrilato o injertos del hueso son 5-17% (Gitelis, 1993; O'Donnell, 1994; Quint, 1998; Capanna, 1985; Durr, 1999; Roca, 1990). El fenol es sistémicamente tóxico. La prevención de la exposición a los tejidos blandos circundantes mientras y al mismo tiempo permitir la exposición de la cavidad cureteada es difícil. Puede causar una quemadura química seria, y también se absorbe fácilmente a través de la piel y de la mucosa. El fenol tiene un efecto peligroso en el sistema nervioso, corazón, riñones, e hígado. Daña la DNA, coagula las proteínas, y causa necrosis celular. Varios autores han sugerido que el fenol se puede absorber a través de los huesos trabecular.
Muchos autores abogan criocirugía con nitrógeno líquido como coadyuvante (Aboulafia, 1994; Marcove, 1982; Marcove, 1978; Malawer, 1999; Malawer, 1991; Pogrel, 1995). Después de realizado el curetaje y de sellar todas las perforaciones en el hueso se sellan, el nitrógeno líquido se vierte a través de un embudo de acero inoxidable en la cavidad. El nitrógeno líquido se deja en la cavidad hasta que se evapora todo. Los tejidos blandos circundantes se irrigan con suero fisiológico caliente con el fin de prevenir o de reducir al mínimo la lesión termal de los tejidos blandos circundantes. El proceso se repite 2-3 veces, dando por resultado la muerte celular en una profundidad de aproximadamente 1-2 centímetros (Grogan, 1984). El defecto cavitario entonces se reconstruye con polimetilmetacrilato o con injertos de hueso. Las tasas de recidiva con la criocirugía se sitúan entre 2-12%. Las desventajas de la criocirugía incluyen la necesidad de una exposición amplia, la necesidad de proteger los tejidos blandos, la necrosis de la piel, la osteonecrosis, y la fractura. La fractura es la complicación más frecuente y la más grave. La fijación interna con clavos de Steinmann y el relleno con cemento disminuye el riesgo de fracturas.
Algunos autores, como alternativa a la criocirugía al fenol, han abogado la coagulación con los rayos de argón. Carece de los peligros del fenol y del nitrógeno líquido. La coagulación térmica aplicada a través de un gas concentrado de argón se utiliza para pintar la cavidad del tumor. La penetración es aproximadamente 2-3 milímetros. El índice de recidiva de esta técnica cuando se asocia al cemento es del 7%. No se observó ninguna complicacion aguda. Falta seguimiento para determinar las complicaciones a largo plazo con respecto a las fracturas y las lesiones del cartílago articular.
En pacientes que han sufrido una fractura patológica importante o hay invasión de las estructuras articulares, se debe considerar la resección en bloque y el uso de un aloinjerto osteocondral, sobre todo cuando las superficies articular no pueden reconstruirse con el uso de la técnica de la cementación. Normalmente, sólo una porción de la superficie articular necesita ser reconstruida. La resección debe consistir en una resección local marginal o amplia, con la extirpación de todos los tejidos afectados. La reconstrucción del defecto con el aloinjerto congelado grande es técnicamente difícil. Debe prestarse atención a hacer los cortes exactos en el hueso y a lograr aposición buena de huésped y hueso del donante así como la fijación interna rígida. Probablemente el injerto óseo en estos sitios disminuye la prevalencia de no-unión. También debe prestarse atención meticulosa a lograr que los tejidos blandos cubran y cierren adecuadamente.
En algunas ocasiones, el tumor de células gigantes ocurre en una área como el sacro en que la resección es sumamente difícil o imposible; tales tumores tienen una proporción muy alta de repetición. El curetaje local y meticuloso sigue siendo el tratamiento principal de tumores del sacro. El esfuerzo debe hacerse para conservar la función neurológica. Si pueden salvarse las dos raíces del nervio de la segunda vértebra sacra y una raíz del nervio de la tercera, el paciente debe mantener normal el intestino, la vejiga, y la función sexual. La resección local amplia que implica un abordaje anterior y posterior puede producir deterioro severo de la función neurológica distal y de la estabilidad columna y debe reservarse para pacientes que tienen un tumor excepcionalmente grande o un tumor en que hay degeneración maligna.
La crioterapia puede tener un lugar en el tratamiento de tumores del sacro; aunque las raíces nerviosas del sacro pueden ser congeladas durante el proceso, pueden regenerarse.
La mayoría de los autores ha estado de acuerdo que la radioterapia debe evitarse en el tratamiento del tumor de células gigantes, ya que hay una alta prevalencia de degeneración sarcomatosa. Sin embardo estudios más recientes han indicado que las técnicas de radiación modernas pueden usarse para tratar el tumor giganto-celular benigno del hueso más eficazmente, estos estudios están en una fase temprana y el periodo de seguimiento es demasiado corto para evaluar adecuadamente el predominio de degeneración sarcomatosa secundaria. La radioterapia debe reservarse para pacientes en quienes la resección completa es imposible.
Las metástasis pulmonares se han tratado con resección amplia, quimioterapia, radioterapia, e interferón alfa. Cuando es posible, la resección quirúrgica amplia es el tratamiento de elección.
Cryosurgery in the treatment of giant cell tumor. A long-term followup study.
Malawer MM, Bickels J, Meller I, Buch RG, Henshaw RM, Kollender Y.
Washington Cancer Institute, Washington Hospital
Center, Washington, DC 20010, USA.
Between 1983 and 1993, 102 patients with giant cell tumor of bone were treated at three institutions. Sixteen patients (15.9%) presented with already having had local recurrence. All patients were treated with thorough curettage of the tumor, burr drilling of the tumor inner walls, and cryotherapy by direct pour technique using liquid nitrogen. The average followup was 6.5 years (range, 4-15 years). The rate of local recurrence in the 86 patients treated primarily with cryosurgery was 2.3% (two patients), and the overall recurrence rate was 7.9% (eight patients). Six of these patients were cured by cryosurgery and two underwent resection. Overall, 100 of 102 patients were cured with cryosurgery. Complications associated with cryosurgery included six (5.9%) pathologic fractures, three (2.9%) cases of partial skin necrosis, and two (1.9%) significant degenerative changes. Overall function was good to excellent in 94 patients (92.2%), moderate in seven patients (6.9%), and poor in one patient (0.9%). Cryosurgery has the advantages of joint preservation, excellent functional outcome, and low recurrence rate when compared with other joint preservation procedures. For these reasons, it is recommended as an adjuvant to curettage for most giant cell tumors of bone.